化粧品の製造販売業とは?製造業との違いや要件を解説
更新日:2025年4月14日
◆もくじ◆
化粧品製造販売業とは
化粧品製造販売業とは、化粧品を日本国内に出荷・流通させる為に必要な許可です。
つまり、「世の中(市場)へ出荷・流通させた化粧品の最終責任者」といえます。
本来、化粧品は「人体に対する作用が緩和」なものではありますが、人の肌につける以上、「肌がただれた」「皮膚に湿疹ができた」「かゆみがおさまらない」等、様々な健康被害につながる可能性があります。
化粧品製造販売業者は、そんな危険性をともなう化粧品の「市場に対する最終責任者」です。

製販分離や輸入化粧品を取り扱う場合も対象
自社で化粧品を製造している場合はもちろん、他社に製造を委託している場合(いわゆる「製販分離」)や、海外から完成した化粧品を輸入している場合であっても、その化粧品の適切な品質を確保する為の重要な責任を負っています。
薬事法では、化粧品製造販売業者に対して、取り扱う化粧品の適切な品質を確保し、その安全性を常に確保し、健康被害を未然に防ぐ為の様々な役割を規定しています。
化粧品製造販売業の許可取得にあたっては、このような<重要な責任を負う「会社or個人」としてふさわしいか>という視点で、組織体制、業務分掌、マニュアル(GVP/GQP等)の制定状況、責任者の知識・経験等について、審査を受ける形になります。
従って、「会社or個人」ごとの申請となります(cf : 化粧品製造業の場合は「場所」ごとの申請になります)。
化粧品製造販売業と化粧品製造業の違い
化粧品の許可には、「化粧品製造販売業許可」と「化粧品製造業許可」の2種類があります。
これらの許可は、それぞれの業務内容や責任範囲に応じて取得が必要となります。
化粧品製造販売業許可は、自社ブランドの化粧品を市場に出荷し、販売するために必要となる許可です。
製造販売業者は、製品の品質や安全性に対して最終的な責任を負い、市場に出荷された製品の品質管理や安全性情報の収集・分析・評価を行い、必要に応じて適切な措置を講じる義務があります。
一方、化粧品製造業許可は、化粧品の製造を行うために必要でな許可です。
製造工程の内容に応じて、さらに「一般区分」と「包装等区分」の2区分に分類されます。
化粧品製造販売業者の役割
化粧品製造販売業者の主な役割は、下記の通りになります。
品質管理及び製造販売後安全管理
- 製造販売しようとする製品の品質管理及び製造販売後安全管理を適正に行うこと
- 一定の要件を満たす総括製造販売責任者/品質保証責任者/安全管理責任者を選任すること
- 総括製造販売責任者が法定の責務を果たす為に必要な配慮を行うとともに、その意見を尊重すること
- 総括製造販売責任者に品質保証責任者・安全管理責任者を適正に監督させること
- 総括製造販売責任者・品質保証責任者・安全管理責任者がそれぞれ相互に連携協力し、その業務を行うことができるよう必要な配慮をすること
- 薬事法が規定する各種文書やGVP・GQPに関する手順書の整備・制定すること
- 上記手順書に基づき、化粧品の品質管理業務に関わる社員に、業務を適正かつ円滑に履行させること
- 上記手順書に基づき作成した記録を、適性に保存すること
消費者への情報提供
- 消費者の問い合わせに対して的確な情報提供ができる体制を整備すること
副作用等の報告
- 製造販売した化粧品について有害な作用が発生するおそれがあることを示す研究報告等を知った時は、30日以内にその旨を厚生労働大臣に報告すること
回収の報告
- 製造販売した化粧品の自主回収に着手した時は、速やかに管轄都道府県知事あてに、法定事項を報告すること
化粧品を製造販売するには?
化粧品製造販売業の要件
化粧品を製造販売するには、以下の要件を満たす必要があります。
①手順書(GQP、GVP)の整備
②<総括製造販売責任者><品質保証責任者><安全管理責任者>の設置
③申請者(法人の場合は業務を行う役員)が欠格事由に該当しないこと
動画でサクッと確認!
①手順書(GQP、GVP)の整備
GQP省令(Good Quality Practice)とは、化粧品の適切な品質管理を維持する為に必要な体制やルールなどの基準が定められた省令です。
GVP省令(Good Vigilance Practice)とは、化粧品の製造販売後の安全管理を確保する為に必要な体制やルールなどの基準が定められた省令です。
化粧品の製造販売業許可を取得するには、このGQP省令及びGVP省令の遵守が要件となっており、この省令に従って業務を適切に運営する為のマニュアルを制定する必要があります。
このマニュアルが「手順書」と言われるもので、化粧品の製造販売業許可の申請にあたっては、薬務課の実地調査の際に、手順書の制定内容、制定状況、対応状況をそれぞれ審査される形になります。
※詳しくは、GVPとGQPをご参照下さい。
②<総括製造販売責任者><品質保証責任者><安全管理責任者>の設置
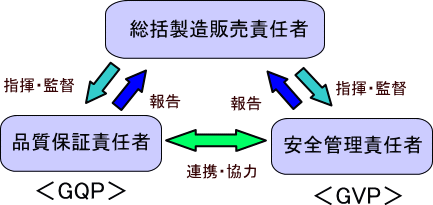
これらの責任者は、①の手順書で定めた業務を実施する上で、要となる責任者であり、よく「3役(3責)」と言われます。
この3役は、「総括製造販売責任者」をトップに、下記のようなトライアングル体制で、適切な業務運営を確保していく形になります。
3役については、各責任者として1名を配員することが望ましいですが、兼務することも可能です。
ただし、兼務する場合でも、各責任者の行うべき役割は果たす必要があります。
「総括製造販売責任者」は、以下いずれかの要件を満たしている必要があります。
また、総括製造販売責任者は、常勤である事が必須となります。
| 必要要件 | 証明書類 | |
| 1 | 薬剤師 | 薬剤師免許 (薬務課窓口での原本商号が必要) |
| 2 | 高校またはこれと同等以上の学校で、薬学または化学に関する専門の課程を修了した者 | 例) 卒業証明書または卒業証書 単位取得証明書 (専攻によっては必要) |
| 3 | 高校又はこれと同等以上の学校で、薬学又は化学に関する科目を修得した後、医薬品、医薬部外品又は化粧品の品質管理又は製造販売後安全管理に関する業務に3年以上従事した者 | 例) 単位取得証明書 従事証明書 |
参考:【化粧品許可】製造販売業に必要な手順書について
化粧品製造販売業の責任者三役について
化粧品製造販売業の責任者三役について、詳しくは以下のページをご参照ください。
GQPとは/GQPの要求事項
GQPとは、製品の品質確保を正しくスムーズに行うために必要なことを定めた取り決めです。
総合的に品質の確保を求められているのがGQPです。
工場での管理をチェックするのはもちろん、市場出荷後の品質について全般的に責任を持つことになります。
品質管理の基準として、「医薬品、医薬部外品、化粧品及び医療機器の品質管理の基準に関する省令(以下「GQP省令」という。)」があります。
GQP省令に適合し化粧品の品質管理にあたっては、GQP省令に適合している必要があります。
GQP省令は製造販売業の許可の条件であり、許可を保持するためにもGQP省令の遵守が条件です。
GQP省令において、化粧品製造販売業者に要求されている事項は以下のとおりです。
これは、必須事項であり、これ以外の事項(自己点検、教育訓練等)の実施を妨げるものではありません。
| 番号 | 内容 | 省令 |
| 1 | 十分な人員を有すること | GQP省令第4条1項(第19条により準用) |
| 2 | 総括製造販売責任者に行わせること | GQP省令第3条(第19条により準用) |
| 3 | 品質保証責任者の設置 | GQP省令第17条 |
| 4 | 品質保証責任者に行わせること | GQP省令第8条(第19条により準用) |
| 5 | 品質管理業務手順書の作成 | GQP省令第18条1項及び第3項 |
| 6 | 品質管理業務の実施 | GQP省令第18条2項 |
| 7 | 文書及び記録の管理 | GQP省令第16条(第19条により準用) |
1:品質管理業務を適正かつ円滑に遂行できる能力を有する人員を十分に有すること
- 業務内容と実務経験及び教育訓練等を照らし合わせ能力を有する者であることを製造販売業者として判断すること。
2:総括製造販売責任者に以下のことを行わせること
- 品質保証責任者の監督及び品質保証責任者の意見の尊重。
- 品質情報等品質保証責任者からの報告等に対して、必要な措置を決定し、その実施を品質保証責任者に指示する。
- 品質保証責任者と安全管理責任者その他関係する業務の責任者との密接な連携を図らせる。
3:品質保証責任者の設置
- 職歴、経験年数、教育訓練状況、学歴等を総合的に判断した上で、品質管理業務を責任を持って任せることのできる者で、かつ化粧品の販売に係る部門に属さない者その他品質管理業務の適正かつ円滑な遂行に支障を及ばすおそれのない者を品質保証責任者として置くこと。
4:品質保証責任者に以下のことを行わせること
- 品質管理業務を統括する。
- 品質管理業務が適正かつ円滑に行われていることを確認する。
- 品質管理業務の遂行のために必要なときは、総括製造販売責任者に文書により報告する。
- 品質管理業務の実施に当たり、必要に応じ、製造業者等その他関係する者に対し、文書による連絡又は指示を行うこと。
5:品質管理業務手順書の作成
- 品質管理業務を適正かつ円滑に実施するため、以下に掲げる手順に関する文書(以下「品質管理業務手順書」という。)を作成すること。
- また、作成した品質管理業務手順書は、総括製造販売責任者が業務を行う事務所に備え付けるとともに、品質管理業務を行うその他の事務所等に、必要な部分の品質管理業務手順書の写しを備え付けること。
| 1 | 市場への出荷に係る記録の作成に関する手順 |
| 2 | 適正な製造管理及び品質管理の確保に関する手順 |
| 3 | 品質等に関する情報及び品質不良等の処理に関する手順 |
| 4 | 回収処理に関する手順 |
| 5 | 文書及び記録の管理に関する手順 |
| 6 | その他必要な品質管理業務に関する手順 己点検に関する手順、教育訓練に関する手順、安全管理責任者との相互の連携に関する手順、 品質標準書の作成、製造業者との取り決め等、製造販売業者が品質管理業務を行う上で 必要な事項について作成すること。 |
6:品質管理業務の実施
製品の品質を確保するため、品質管理業務手順書に基づき、次の業務を行う。
①市場への出荷に関する記録の作成
| 1 | 製造管理及び品質管理の結果を適正に評価し、市場への出荷の可否の決定をロットごとに行う。評価する際に、確認する事項として以下のものが考えられる。 ア 製造記録の確認(品質標準書どおり製造されているかの確認) イ 試験検査記録の確認(品質標準書の規格を満たしているかの確認) ウ その他(原料、製造方法の変更等の有無、保管状況等の確認) |
| 2 | 1の出荷可否の結果及び出荷先等に関する記録を作成する。 回収等の措置が速やかに実施できるようロットに関する記載も行うこと。 作成する記録として以下のものが考えられる。 ア 製造管理及び品質管理の結果の評価に係る記録 イ 市場への出荷の可否の決定に関する記録(販売名、ロット番号、決定者、決定日等を記載) ウ 出納記録(販売名、ロット番号、出納数量、出荷先等を記載) |
②適正かつ円滑に製造されたことの確認及び記録作成
取り決めに基づく実地確認等により、製造業者等において適正かつ円滑に製造されたものであることを確認し、その記録を作成する。
③品質情報の処理及び記録作成
品質等に関する情報(苦情等を含む。)を得たときは、その情報に係る事項による人の健康に与える影響に関する、評価・原因の究明を行い、改善が必要な場合は、必要な措置を行う。
また、これらの記録を作成する。
④安全管理責任者への文書による連絡
品質情報のうち、安全確保措置に関する情報は、安全管理責任者に遅滞なく文書で提供する。
⑤回収等の措置及び記録作成
品質不良又はそのおそれが判明した場合は、回収等の必要な措置を速やかに実施し、その記録を作成する。
なお、「出荷に関する記録」にロットに関する記載がない場合は、ロットを限定することなく市場へ流通している可能性のあるすべてのロットを対象とすることになる。
7:文書及び記録の管理
- 品質管理に係る文書及び記録は、作成の日(品質管理業務手順書については使用しなくなった日)から5年間保存すること。
- 文書を作成し、又は改訂したときは、当該文書の承認、配布、保存等を行うこと。
- 品質管理業務手順書には、作成責任者及び作成年月日、並びに改訂責任者、改訂年月日、改訂事項及び改訂理由を記載の上、改訂履歴を保存すること。
GVPとは/GVPの要求事項
GVPとは、「製品の安全」に関することを定めた取り決めです。
「これは有害作用ではないか?」という情報を収集・検討し、どのような対応をするのか、ルールを決めたものです。
化粧品の場合、重い副作用・有害作用が起こる頻度は比較的低いと思われますが、決してゼロではありません。
「肌がかぶれた」、「かゆみを感じる」などの有害作用は起こり得ます。
また、専門誌や研究論文などで成分の有害作用について発表されることもあるかもしれません。
万が一に備え、有害作用による被害をできるだけ少なくするために、あらかじめ対応を決めておく必要があります
製造販売後安全管理の基準として、「医薬品、医薬部外品、化粧品及び医療機器の製造販売後安全管理の基準に関する省令(以下「GVP省令」という。)」があります。
化粧品の製造販売後安全管理には、GVP省令に適合している必要があります。
GVP省令は製造販売業の許可の条件であり、許可を保持するためにもGVP省令の遵守が条件です。
GVP省令において、化粧品製造販売業者に要求されている事項は以下のとおりです。
これらは必須事項であり、これ以外の事項(自己点検、教育訓練等)の実施を妨げるものではありません。
(化粧品製造販売業者は、GVP省令中の「第三種製造販売業者」に該当します)
| 番号 | 内容 | 省令 |
| 1 | 十分な人員を有すること | GVP省令第13条(第15条により準用) |
| 2 | 総括製造販売責任者に行わせること | GVP省令第3条(第15条により準用) |
| 3 | 安全管理責任者の設置 | GVP省令第13条(第15条により準用) |
| 4 | 安全管理責任者に行わせること | GVP省令第6条(第15条により準用) |
| 5 | 安全管理業務の実施 | GVP省令第7条から9条(第15条により準用) |
| 6 | 文書及び記録の管理 | GVP省令第16条 |
1:安全確保業務を適正かつ円滑に遂行できる能力を有する人員を十分に有すること
- 安全確保業務を適正かつ円滑に遂行しうる能力を有する人員を十分に有すること。
2:総括製造販売責任者に以下のことを行わせること
- 安全管理責任者の監督及び安全管理責任者の意見の尊重 ・安全管理責任者と品質保証責任者その他の化粧品の製造販売に係る業務の責任者との密接な連携を図らせる
3:安全管理責任者の設置
- 安全確保業務を適正かつ円滑に遂行しうる能力を有する者で、かつ化粧品の販売に係る部門に属さない者・その他安全確保業務の適正かつ円滑な遂行に支障を及ばすおそれのない者を安全管理責任者として置くこと。
4:安全管理責任者に以下のことを行わせること
- 安全確保業務を統括する
- 安全確保業務が適正かつ円滑に行われていることを確認し、その記録を作成し、保存する
- 安全確保業務の遂行のために必要なときは、総括製造販売責任者に文書により報告し、その写しを保存する。
5:安全管理業務の実施
製品の安全を確保するため、次の業務を行うこと
①安全管理情報の収集
安全管理責任者は、以下に掲げる安全管理情報を収集し、その記録を作成し、保存する。
ア 学会報告、文献報告その他研究報告に関する情報
イ その他の安全管理情報
②安全管理情報の検討
安全管理責任者は、収集した安全管理情報を遅滞なく検討し、その結果を記録すること。
また、安全管理情報のうち、品質保証責任者が把握する必要があると認められる場合にあっては、当該安全管理情報を品質保証責任者に遅滞なく文書で提供すること。
③安全確保措置の立案
安全管理責任者は安全管理情報を検討した結果、必要と認めるときは、廃棄、回収、販売の停止、添付文書の改訂、情報の提供又は法に基づく厚生労働大臣への報告(副作用等報告、回収報告等)その他の安全確保措置を立案し、その案を総括製造販売責任者に文書により報告すること。また、その写しを保存すること。
| 番号 | 安全確保措置の内容 |
| 1 | 総括製造販売責任者は、以下に掲げる業務を行う事 ・安全確保措置案を適正に評価し、安全確保措置を決定するとともに、その記録を作成し、保存する。 あらかじめ文書に定める事項については、総括製造販売責任者に代わり安全責任者が行うことができる。 ただし、この場合、安全確保措置の実施業務について必要な事項をあらかじめ文書に定めておくことが必要 ・安全管理責任者に、安全確保措置を行わせる場合は、その実施について文書により指示し、それを保存させる。 ・安全管理責任者以外の者に、安全確保措置を行わせる場合は、その実施について文書により指示し、その写しを安全管理責任者に保存させる。 ・安全管理責任者以外の者に、安全確保措置を行わせる場合は、その者に実施についての記録を作成させ、文書により総括製造販売責任者に報告させるとともに、その写しを安全管理責任者へも交付させる。 |
| 2 | 安全管理責任者は、以下に掲げる業務を行う事 ・総括製造販売責任者の指示に基づき安全確保措置を行い、その記録を作成し保存する。 ・安全確保措置の実施の結果等について、総括製造販売責任者に文書により報告し、その写しを保存する。 |
6:文書及び記録の管理
- GVP省令により保存することとされている文書その他安全管理業務に係る文書及び記録は、当該記録等を利用しなくなった日から5年間保存すること。
ただし、生物由来製品に係る記録については利用しなくなった日から10年間、特定生物由来製品に係る記録については利用しなくなった日から30年間保存すること。
化粧品に関する許認可のご相談はサポート行政書士法人へ
サポート行政書士法人では、新規で化粧品業界へ参入される方から、既存の製造販売業者・製造業者・販売業者の皆さまに対して、医薬品医療機器等法に関する申請サポートやコンサルティングを行っています。
化粧品の申請は専門性が高く、対応している行政書士が少ない分野の一つと言えます。
弊社の担当者は、全国の都道府県で申請・届出実績があります。ぜひご相談ください。

【GQP・GVP】法務管理の一括アウトソーシングも可能
化粧品許可に関する法律は頻繁にアップデートされており、特に近年はコンプライアンス意識の強化が顕著です。
違反が発覚した場合、最悪「商品回収」や「課徴金」というリスクがあるため、継続的な注意が欠かせません。
「許可取得当時は問題なくても、気が付くと法令違反に陥っている」という事例もあることから、リスク管理には専門家による一括管理がおすすめです。
「許可の更新を控えている事業者様」「前任者がいなくなってしまったが後任者の育成が追い付いていない事業者」には特におすすめの内容となっています。



