輸入の手続き、輸入確認証(旧薬監証明)
更新日:2025年3月21日
様々な理由により海外からいろいろな物が輸入されています。しかし、医薬部外品の輸入には制約があり、通関が許されないことも多々あります。
ここでは医薬部外品の輸入通関にかかる手続きの概要をお伝えします。
◆もくじ◆
1.医薬部外品の輸入を制限する理由
医薬部外品をはじめ、医薬品、化粧品、医療機器、体外診断用医薬品及び再生医療等製品(以下「医薬品等」と呼ぶ)は、人の生命、健康に直接関わるものです。
そのため、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下「医薬品医療機器等法」と呼ぶ)という法律で、その有効性と安全性について詳細に検討を行った上で、それらが十分なものと認められたものだけが国内に流通させられるように規制されています。
輸入貨物の性質によっては、毒物及び劇物取締法(以下「毒劇法」と呼ぶ)による規制による場合もあります。 税関では通関手続きにてこれを確認しています。
2.目的により変わる手続き
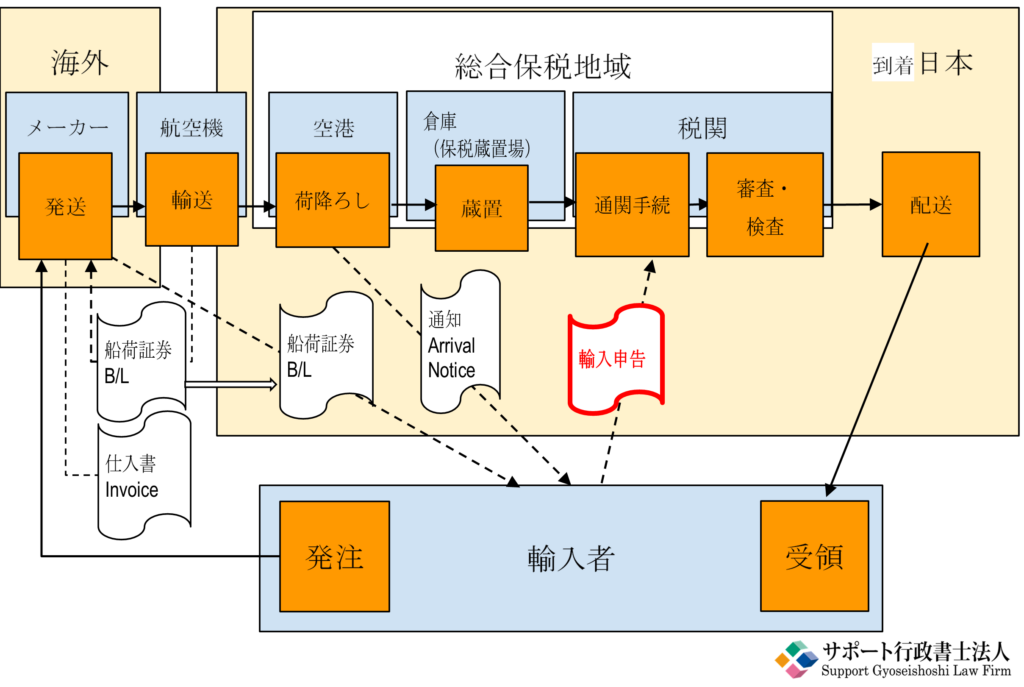
輸入の流れ概要は下記のようなものです。
輸入手続きは、輸入する製品の区分(例えば医薬部外品該当か)、輸入者(許可業者か)及び目的等によって変わります。 準備する資料もそれぞれによって異なります。
また、輸入する製品が「医薬品医療機器等法又は毒劇法の規制下のものか否か」は税関の担当官の判断による、ということも重要ポイントです。 税関についてから「通関できない!」となることもしばしば耳にします。
(輸入の流れ概要)
3.許可業者が承認・届出済の製品を輸入する場合
医薬品等を販売、貸与もしくは授与できるのは、該当する区分の製造販売業の許可を受けた者(以下「製造販売業者」と呼ぶ)だけであることが医薬品医療機器等法に定められています。
この製造販売業者は医薬部外品の製造を、該当区分の製造業の許可を受けた製造業者(以下「製造業者」と呼ぶ)に委託することができます。 つまり、「販売、貸出、譲渡を目的として輸入できるのは製造販売業者又は製造業者のみ」、ということです。
この場合、輸入申告の際、医薬品医療機器等法上の許可、承認等を受けていることを税関に証明する必要があります。
| 許可を受けた業者であることの証明 | 医薬品等の製造販売業許可証 医薬品等の製造業許可証 |
| 医薬部外品として、製品の有効性と安全性が 確認されていることの証明 | 医薬品等の製造販売承認書 医薬品等の製造販売認証書 医薬品等の製造販売届書 |
4.輸入確認証(旧薬監証明)を取得、提示して輸入できる場合
上記3に該当しない場合でも、その目的によっては通関前に管轄厚生局より「輸入確認証(旧薬監証明)」を入手することで通関できるようになる場合があります。
輸入者が作成し通関前に厚生局に提出した「輸入確認申請書(旧輸入報告書等)」を含む資料を基に、 厚生局の薬事監視専門官/毒物劇物監視員が確認を行います。
確認の結果、医薬品医療機器等法又は毒劇法に違反しないと認められた場合に限り「輸入確認申請書(旧輸入報告書等)」に「厚生労働省確認済印」が押され、輸入者に戻されます。 この流れを「輸入確認」と呼び、それを証明する書類が「輸入確認証(旧薬監証明)」です。
これを税関に提出することで、通関が可能となります。 輸入確認証(旧薬監証明)は次の場合、それぞれに応じた書類を提出することで受けることが可能です。 (平成27年11月30日薬生初1130第2号より抜粋)
| イ | 承認等を受けていない医薬品等を臨床試験用に輸入する場合(治験計画届書提出未) 1. 企業A主体の治験の為に、企業A自らが輸入する場合 2. 企業A主体の治験の為に、企業Aが輸入し企業Bに供給する場合 3. 医師又は歯科医主体の臨床試験の為に、自らが輸入する場合 4. 医師又は歯科医主体の臨床試験の為に、企業Aが輸入し医師又は歯科医に供給する場合 ※治験計画届書提出済、臨床試験データベースに臨床試験情報が登録されている場合には、輸入確認証(旧薬監証明)不要で税関確認のみで通関できます。((6)-イロ) |
| ロ | 承認等を受けていない医薬品等を臨床試験用に輸入する場合(治験計画届書提出未)において、企業A主体の治験の為に、企業Aが輸入し企業Bに供給する場合 |
| ハ | (医薬品、医療機器、体外診断用医薬品又は再生医療等製品) 許可業者が、試験研究等に使用する目的うち、次の場合 1. 試験研究(品質試験、薬理試験、製剤化試験等)用の場合 2. 社内見本用(商品価値判断のため。第三者への販売、譲渡、貸与はNG) ※許可業者が包装機械等の試験の為に使用する場合(使用後は輸出国への積戻し又は廃棄)には、輸入確認証(旧薬監証明)不要で税関確認のみで通関できます。((6)-ハ) |
| ニ | (医薬部外品又は化粧品) 許可業者が、試験研究等に使用する目的のうち、次の場合 1. 試験研究(品質試験、薬理試験、製剤化試験等)用の場合 2. 社内見本用(商品価値判断のため。第三者への販売、譲渡、貸与はNG) ※許可業者が包装機械等の試験の為に使用する場合(使用後は輸出国への積戻し又は廃棄)には、輸入確認証(旧薬監証明)不要で税関確認のみで通関できます。((6)ハ) ※許可業者が社内見本用として1品目36個以内を輸入する場合には、輸入確認証(旧薬監証明)不要で税関確認のみで通関できます。((6)ニホ) |
| ホ | 医薬品等の製造販売業又は製造業の許可を受けていない者が試験研究又は社内見本用として医薬品等を輸入する場合 |
| ヘ | 展示用に輸入する場合のうち、以下の場合 1. 学会、公的機関等が主催又は後援する展示会等で、学術研究の向上、発展、科学技術又は産業の振興等を目的として展示 民間企業等が主催する見本市に広告宣伝を目的としない医薬部外品を展示 |
| ト | 個人用の場合 1. 「数量に関わらず厚生労働省の確認を必要とするもの」として通知されているものに該当するもの(平成22年3月19日食監麻発0319第4号) 2. 輸入者自身が個人的に使用することが明らかな数量(通関取扱要領第2の1(6)ヌで定める数量)を超えるもの※この数量を超えない場合には輸入確認証(旧薬監証明)不要で税関確認のみで通関できます。((6)ヌ) 3. 医家向けの医療機器(医療従事者ではない個人が、家庭用(家庭で自己が使用するもの)として使用するもの) 個人使用の目的であっても、輸入貨物の宛先が会社や団体等自宅以外になっているもの若しくは送付状に会社名や団体名等が記載されているもの |
| チ | 医師等が治療に用いるために、治療上緊急性があり、国内に代替品が流通していないものを輸入 |
| リ | 再輸入品・返送品用 |
| ヌ | 自社製品の原料として輸入する場合 (自家消費) |
| ル | その他、厚生労働省医薬・生活衛生局監視指導・麻薬対策課長が、保健衛生上の観点等から、輸入することが特に必要と認める場合 |
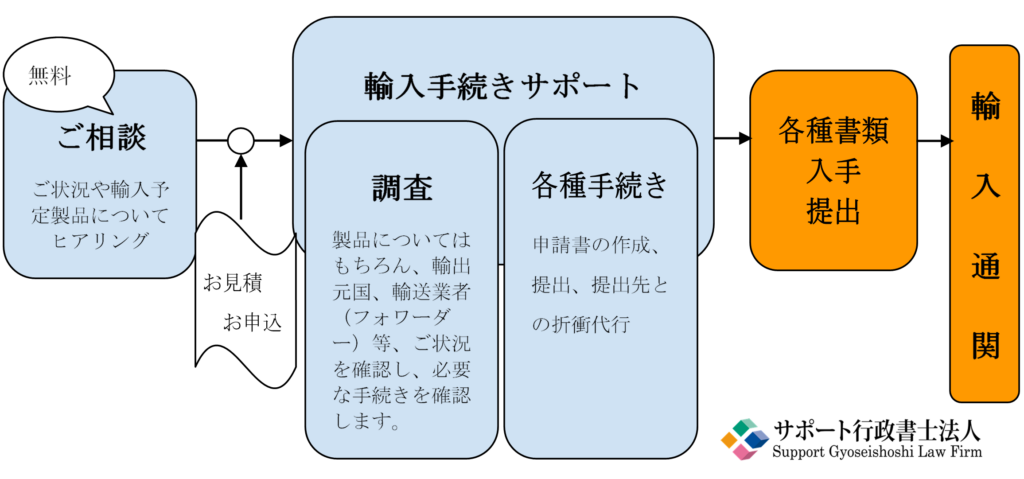
5.医薬部外品輸入事業サポートサービスの流れ
6.サポート行政書士法人にお任せください。
①スピード対応
弊社のスピード対応は多くのお客様から評価いただいており、組織体制の構築から書類作成、許可取得を経た後の事業開始まで、御社の1日でも早い参入をサポートします。
②コンタクトしやすい体制
弊社ではご相談は無料で受けています。
私どもは東京・名古屋・大阪の全国3箇所にオフィスを構えており、そこを起点に全国対応しています。
インターネット等を用いて海外からのご相談も承っておりますし、営業時間外でも事前にご予約いただければ、夜間や土日祝の相談も可能です。
中国語・英語・韓国語対応のスタッフもいますので、日本語では相談が難しい場合でも対応が可能です。
医薬部外品許可申請のことでお困りの方はどんなことでもぜひ私たちにご相談ください!
③コンプライアンス体制構築もしっかりサポート
手順書(GVP、GQP)等について、基準を満たしつつも貴社の実態に合う形で作成することが可能です。
許可の更新の経験も豊富にあり、内部監査のサポートも提供しています。
事業者様にとって許可取得はゴールではなくスタートです。
先を見据えたサポートをしっかりと提供します。

専任スタッフが全国の案件を対応しています。