承認事項の変更
更新日:2025年3月21日
医薬部外品の製造販売承認を受けた品目について、承認された事項の一部を変更しようとする場合、基本的に手続きが発生します。
この事項の恐ろしいところは、きちんと手続きを把握していないと、 「変更していたのに手続きしてなかった!」や、 「変更後に手続きをしたところ、実はこの変更により、承認要件を満たせなくなっていた事が判明!」という、 企業生命にかかわる大事件になりうることです。
そのような事態にならないために、正確に「変更手続きすべき変更」と「変更に応じた手続き」を把握して、適切な対応をとることが必要です。
私どもサポート行政書士法人では、医薬部外品の承認内容の変更に伴う手続きについて数多く実績がございます。 もし承認内容の変更をお考えなら、どうぞお気軽にご相談ください。
◆もくじ◆
1.変更手続きの流れと注意ポイント
承認品目について、承認された事項の一部を変更しようとする場合、ケースにより手続きが変わります。 大まかに分けると下記の二つです。
● 「厚生労働大臣の承認を受けなければならないもの(新規承認申請又は一部変更承認申請(以下「一変」と呼ぶ)」
● 「厚生労働大臣へ届出をするもの(いわゆる「軽微変更届出」)」 変更内容に応じて、取るべき手続きを下表にまとめました。
| 変更内容 | 手続きの種類 |
| 販売名、有効成分若しくはその分量又は剤型の変更(S55.4.10薬発483第六の5(1)ア) | 変更前に厚生労働大臣の承認 (新規承認申請) |
| 有効成分以外の成分若しくは分量、用法、用量、効能、効果又は規格及び試験方法等の変更(S55.4.10薬発483第六の5(1)イ) | 変更前に厚生労働大臣の承認 (一変) |
| 以下のア~オ以外の変更(薬食発第0709004) ア. 製品の本質、特性、性能及び安全性に影響を与える製造方法等の変更 イ. 規格及び試験方法に掲げる事項の削除及び規格の変更 ウ. 病原因子の不活化又は除去方法に関する変更 エ. 用法、用量、効能又は効果に関する追加、変更又は削除 オ. その他製品の品質、有効性及び安全性に影響を与えるおそれのあるもの | 変更後30日以内に厚生労働大臣へ届出 (軽微変更) |
(参考:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下「医薬品医療機器等法」と呼ぶ)施行規則第47条)
2.変更の具体例
変更内容の具体例として下記のような通知もされています。
| 変更内容 | 手続きの種類 |
| GMP対象外の医薬部外品について、製造所及び製造工程の変更 | 品質に明らかな影響を与えないことを担保した上で軽微な変更の届出を行うことでよい(H17.3.23 審査管理課事務連絡、H17.2.10 薬食審査発 0210001)) |
| 製造所における人員及び構造設備に変更がなく、製造所の名称のみが変更される場合 | 軽微変更届出により変更することでよい。ただし、新たに製造所の許可を取得する必要がある場合は、許可取得後に軽微変更届出を行う。(H20.8.26 審査管理課事務連絡) |
| 市町村合併等による製造所の住所が変更になった場合、住居表示を改めるのみの変更 | 軽微変更届出の提出をする必要はなく、他の理由による一部変更若しくは軽微変更届出を行う機会のあるときに合わせて変更することで差支えない。(H18.12.14 審査管理課事務連絡) |
| 承認書に記載されている製造所の許可(又は認定)年月日が更新された場合 | 軽微変更届出の提出をする必要はなく、他の理由による一部変更若しくは軽微変更届出を行う機会のあるときに合わせて変更することで差支えない。(H18.12.14 審査管理課事務連絡) |
| 賦形剤・色素・香料・防腐剤・安定剤等が変更される場合 | 原則として、効能又は効果に変更をきたさない範囲での有効成分以外の成分の変更は、一部変更承認申請の範疇とされる。 (S55.4.10薬発483第六の5(1)イ) |
| 剤形が変更された場合 | 原則として、その品目の効能効果に影響を与えないかつ極端な外観の変更がない場合は、一部変更承認申請の範疇とされる。 (S55.4.10薬発483第六の5(1)ア) |
| エアゾール剤の容器が変更された場合 | 容器の形状を一定の範囲内で変更する場合には(容器の材質、機能に変更が無い場合に限る。)承認事項の一部変更の手続きを要しない。 (S63.2.25薬審二155、H4.12.22薬審832) |
3.手続きの注意ポイント
①軽微変更は変更後30日以内提出!
軽微変更の場合、変更後30日以内に提出することとされています。(施行規則第48条第2項)
しかし、この変更後とはどの時点のことを指すのでしょうか。
これについては、通知にて下記のいずれかであることが示されています(H19.1.12 薬食審査発 0112001)。 届出者において適切な判断が求められています。
軽微変更届出における変更の時点は…
「当該変更を行った時点」あるいは「当該変更により製造された製品の出荷時」のいずれかを変更時点と定め、軽微変更の届出は、その日から 30 日以内に行わなければならない。
②軽微変更の届出=受理ではない!
軽微変更届出が受理されたことをもって、当該変更が妥当であることや軽微変更届の範囲であることが確認されたものではないことが示されています。
別の一部変更承認申請において当該部分にかかる審査の妥当性が確認される他、GMP調査において軽微変更届の範囲でないことが判明することがあるとされています。 (H18.12.14 審査管理課事務連絡Q22)
4.承認事項の変更サポートサービスの流れ
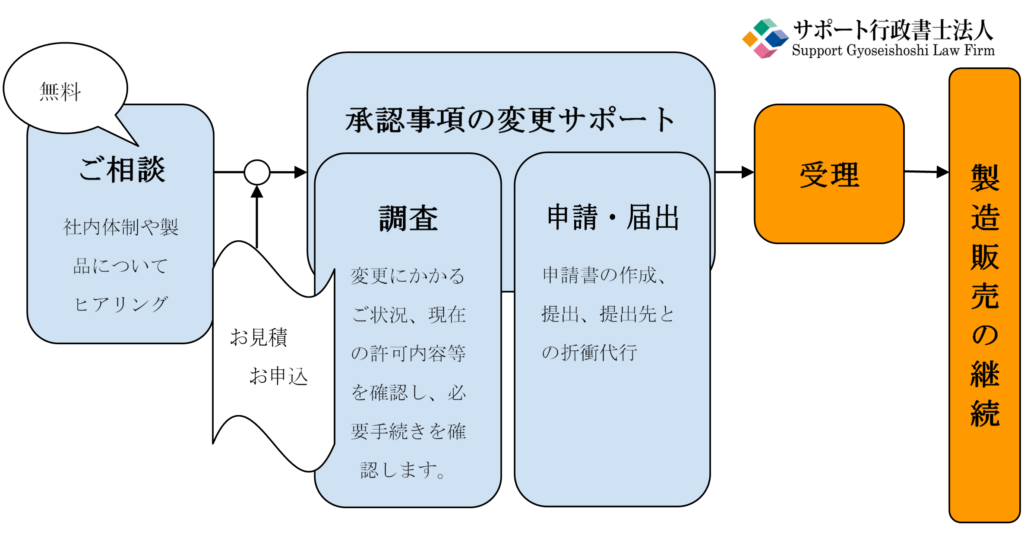
5.サポート行政書士法人にお任せください。
私どもサポート行政書士法人では、医薬部外品にかかる手続きについて数多く実績があり、専門スタッフがお客様の各種申請を迅速かつ確実に代行しています。
①スピード対応
弊社のスピード対応は多くのお客様から評価いただいており、組織体制の構築から書類作成、許可取得を経た後の事業開始まで、御社の1日でも早い参入をサポートします。
②コンタクトしやすい体制
弊社ではご相談は無料で受けています。
私どもは東京・名古屋・大阪の全国3箇所にオフィスを構えており、そこを起点に全国対応しています。
インターネット等を用いて海外からのご相談も承っておりますし、営業時間外でも事前にご予約いただければ、夜間や土日祝の相談も可能です。
中国語・英語・韓国語対応のスタッフもいますので、日本語では相談が難しい場合でも対応が可能です。
医薬部外品許可申請のことでお困りの方はどんなことでもぜひ私たちにご相談ください!
③コンプライアンス体制構築もしっかりサポート
手順書(GVP、GQP)等について、基準を満たしつつも貴社の実態に合う形で作成することが可能です。
許可の更新の経験も豊富にあり、内部監査のサポートも提供しています。
事業者様にとって許可取得はゴールではなくスタートです。
先を見据えたサポートをしっかりと提供します。

専任スタッフが全国の案件を対応しています。

