機能性表示食品 資料作成の手順
更新日:2024年3月20日
目次
➀事前調査
目的の確認
機能性表示食品申請目的を確認するために、まず以下のような内容を確認します。
- いつ発売する予定ですか?
- 機能性関与成分と想定する成分は何ですか?
- どんな機能性表示文言をしたいですか?
- 機能性関与成分の機能性と安全性確認に関する資料をお持ちですか?
- (資料が既にある場合はその確認も)
事前準備
情報収集、確認
機能性関与成分の機能性、安全性について、論文があればその内容を読解し、機能性関与成分に関する迅速な調査が可能です。
論文がない場合、もしくは情報が得られない場合、すべての機能性及び安全性に関する資料の調査を行います。
研究レビューのための文献確認
機能性関与成分の安全性書類を確認し、副作用などについて論文調査を行います。
そして、相関する論文数をどのぐらいあるかを調査します(日本語・英語の論文の題名と要旨の検索など、簡易的な調査を行います)。
商品の機能性関与成分で届出した際の、資料作成用の必要情報
- 安全性評価に関する根拠
- 生産・製造及び品質の管理
- 機能性の科学的根拠(研究レビューまたは臨床試験)
- 健康被害の情報収集体制
- 表示の内容/表示見本
※不足情報の種類により予想時間が異なます。
この段階での作成書類
1.別紙様式(Ⅰ)
②機能性の科学的根拠の証明(※1)
科学的根拠を説明するものとして、以下のいずれかによる資料を用意します。
(ⅰ)最終製品を用いた臨床試験
(ⅱ)最終製品又は機能性関与成分に関する研究レビュー
(ⅰ)最終製品を用いた臨床試験
届出に際しては、機能性の科学的根拠資料として、
(1)臨床試験に関する査読付き論文、
(2)機能性の科学的根拠に関する点検表、
(3)臨床試験に関する一般消費者向けの抄録
の3点を提出します。
(1) 臨床試験に関する査読付き論文
臨床試験の結果について、国際的にコンセンサスの得られた指針(CONSORT 2010 声明)に準拠した形式で査読付き論文として発表された論文を提出します。なお、公表準備段階(印刷中(in press)等)の論文を届出資料とした場合は、当該論文の公表後、速やかに届出資料の変更(公表論文への変更)が必要です。
(2)機能性の科学的根拠に関する点検表
臨床試験に関する届出資料等について、作成及び提出漏れ等を防ぐ観点で、別紙様式(Ⅴ)及び別紙様式(Ⅴ)-1を用いて自己点検を行います。
なお、複数の機能性に関する表示を行う場合は、機能性の数だけ別紙様式(Ⅴ)-1が必要です。
(3)臨床試験に関する一般消費者向けの抄録
抄録の標題は40文字以内、本文は1000文字以内とし、一般消費者が容易に理解できるよう言葉を使います。
(ⅱ)最終製品又は機能性関与成分に関する研究レビュー
研究レビューを提出資料とする場合は、以下の資料を提出します。
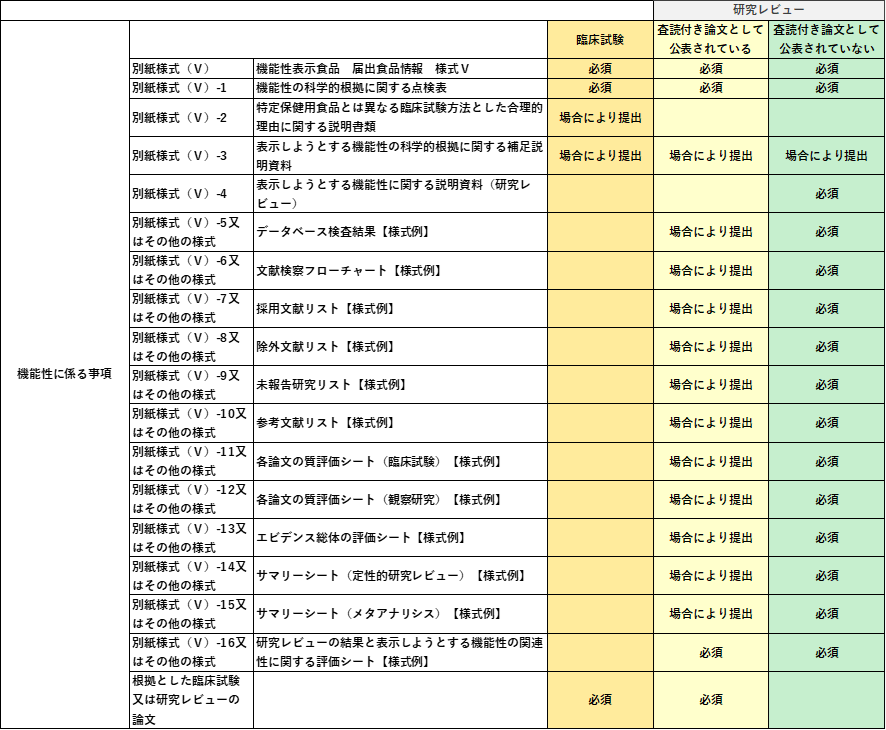
*上記は提出必須書類となります。場合によりその他の資料が求められます。
*別紙様式(Ⅴ)-14は定性的システマティックレビューを実施した場合、別紙様式(Ⅴ)-15は定量的システマティックレビューを実施した場合です。
*査読付き論文は英語又は日本語でない場合は、翻訳した資料を併せて提出する必要があります。
③安全性に係る事項(※2)
届出書類作成は以下5つの部分に分けることができます。
- 安全性評価に関する根拠
- 生産・製造及び品質の管理
- 機能性の科学的根拠(研究レビューまたは臨床試験)
- 健康被害の情報収集体制
- 表示の内容/表示見本
まずは安全性の根拠から説明します。
届出をしようとする食品の安全性については、食経験及び最終製品に含有する機能性関与成分と医薬品との相互作用等の観点から、届出者の責任において自ら評価するものです。
具体的には、食経験の評価をまず行い、食経験に関する情報が不十分である場合には既存情報により安全性の評価を行います。
食経験及び既存情報による安全性の評価でも不十分な場合には、安全性試験を実施して、安全性の評価を行います。
なお、全ての食品について、医薬品と機能性関与成分の相互作用の評価が必要となります。
また、複数の機能性関与成分による機能を表示する場合には、機能性関与成分同士の相互作用についても評価をする必要があります。
最終製品または機能性関与成分における安全性試験の既存情報または試験実施により健康被害情報などを確認し、安全性の評価を行います。
最終製品を使用した安全性試験に関する既存情報を得ることが困難な場合は、機能性関与成分を用いた安全性評価を行います。
この段階での作成書類
- 別紙様式(Ⅱ)
- 別紙様式(Ⅱ)-1
- 安全性試験に関する報告資料
*安全性試験を実施した場合のみとなります。
④生産・製造および品質の管理(※3)
生産・製造及び品質管理に関する資料は、届出をしようとする食品を生産・製造するすべての施設ごとに、取組状況について記載し、関連する資料を添付します。
生産・製造及び品質管理の体制に関する届出資料は、届出食品が「サプリメント形状の加工食品又はその他の加工食品」または「生鮮食品」のどちらに該当するかで異なります。
また、製造施設がGMP、HACCP、ISO22000、FSSC22000の承認等を受けている場合と受けていない場合では、書類の記載方法や添付資料が異なります。
届出において必要となる生産・製造及び品質管理に係る情報は以下の4つに分類されます。
⑴生産・製造及び品質管理の体制
生産・製造及び品質管理に関する資料は、届出をしようとする食品を生産・製造する全ての施設ごとに、取組状況について別紙様式(Ⅲ)、別紙様式(Ⅲ)-1、別紙様式(Ⅲ)-2、別紙様式(Ⅲ)-3に記載し、関連資料を添付します。
なお、届出内容の根拠となる資料や製造管理や分析を実施する上で発生する記録等は、消費者庁等から求められた際に速やかに提示できるよう、適切に保管することです。
⑵食品の分析
別紙様式(Ⅲ)-3に記載し、必要に応じて以下の(ア)~(エ)を添付資料(非公開)として添付します。届出資料に記載するためには、以下の資料、情報等が必要です。
(ア) 分析試験成績書
(イ) 分析方法を示す文書
(ウ) 届出後における分析の実施に関する資料
(機能性関与成分及び安全性を担保する必要がある成分)
(エ) 届出後における分析の実施に関する資料
(原料の基原の確認方法及び製品の崩壊性試験等を実施する必要がある場合、その方法及び頻度)
⑶食品の保管
健康被害が発生した場合において、届出をした食品との因果関係を確認するため、必要な数のサンプルを適切に保管します。
また、保管方法は、食品の特性に応じて、機能性関与成分の変質も考慮し保管を行うことが望ましいです。
なお、生鮮食品については、その特性に応じて、適切な保管期間及び方法を設定します。
⑷文書、記録の保管
製造等に関する文書・記録を保管することは、適切な管理が維持されていることを示すものであるとともに、問題が生じた際には、その原因の特定及び問題の改善に役立てる観点から、非常に重要です。
文書や記録の保存期間は、当該文書が有効である期間や食品の流通実態等のほか関連法令における規定を踏まえて合理的な期間を設定します。
機能性表示食品の届出に当たっては、生産・製造における衛生管理及び品質管理の観点から、以下の資料に基づき、安全性の確報を説明します。
- 生産・製造及び品質管理の体制に関する事項
- 食品中の機能性関与成分等の分析に関する事項
届出資料は共通して提出する資料のほかに、機能性に係る事項については、「臨床試験」、「査読付き論文として公表されている研究レビュー」、「査読付き論文として公表されていない研究レビュー」によって、提出すべき資料がそれぞれ異なります。
また、「サプリメント形状の加工食品及びその他加工食品」と「生鮮食品」についても提出書類が異なります。
この時点での作成書類
1,別紙様式(Ⅲ)
2,その他の様式
⑤健康被害の収集に係る事項(※4)
機能性表示食品の摂取による健康被害の発生の未然防止及び拡大防止を図るため、届出者は健康被害の情報を収集し、行政機関への報告を行う体制を整備することが適当です。
また、機能性表示食品は、医薬品と異なり摂取が限定されるものではないことから、万が一、健康被害が発生した際には、急速に発生が拡大するおそれが考えられます。
そのため、入手した情報が不十分であったとしても速やかに報告することが望ましいです。
作成例
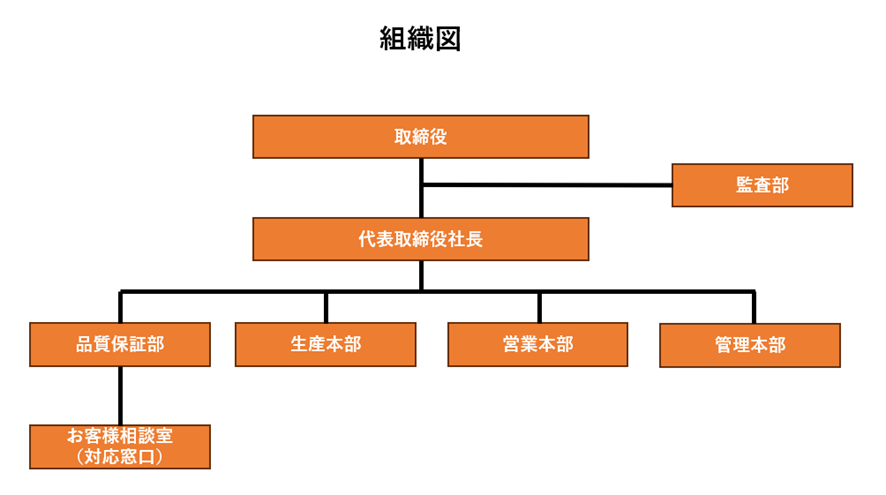
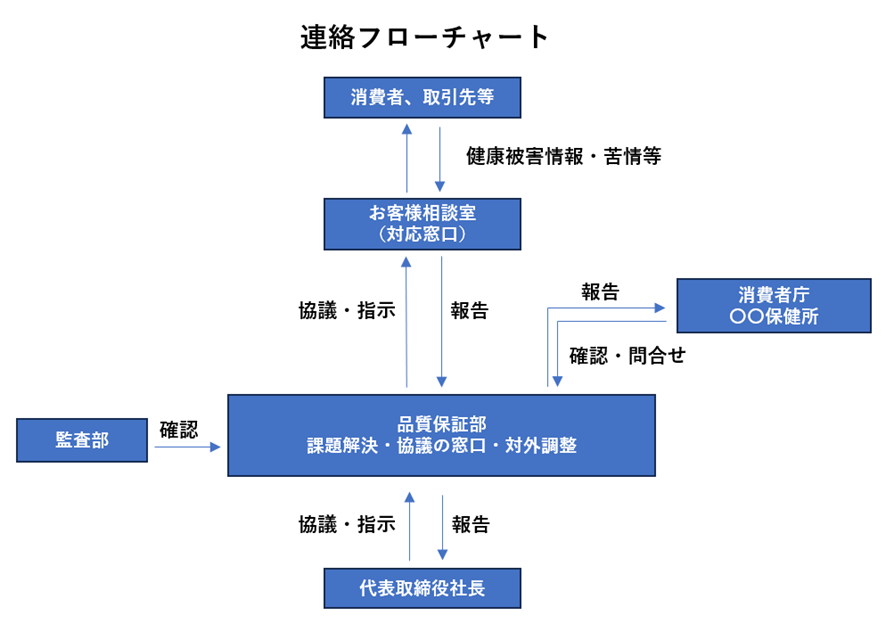
この時点での作成書類
・別紙様式(Ⅳ)
・組織図
・連絡フローチャート
※健康被害の情報の対応窓口部署の記載:連絡フローチャートに記載した組織、部署、担当等は、それが組織図のどこに該当するか分かるように記載します
⑥作用機序(※5)
機能性関与成分が生体内に何らかの効果を及ぼす仕組み、メカニズムなどを説明する作用機序の説明文章。この情報は研究レビューで採用される論文から、ふさわしい表示文言を引用することがあります。
表示しようとする機能性の作用機序は、in vitro試験(細胞実験等)、 in vivo(動物実験等)、臨床試験(ヒト試験)を用いて考察されている必要があります。機能性が複数ある場合は、機能性ごとの作用機序を記載する必要があります。
機能性関与成分が複数ある場合は、単独の各成分だけでなく、複数の成分としての作用機序を考察する必要があります。作用機序の考察には、図やイラスト等を使用することができます。
なお、作用機序については、ヒト試験による考察は必須ではなく、in vitro試験(細胞実験等)やin vivo(動物実験等)の考察をもって示すことができます。
この時点での作成書類
- 別紙様式(Ⅶ)-1
- 表示見本
⑦届け出る食品に関する表示の内容(※6)
- 機能性表示食品である旨
- 科学的根拠を有する機能性関与成分及び当該成分又は当該成分を含有する食品が有する機能性
- 栄養成分の量及び熱量
- 一日当たりの摂取目安量当たりの機能性関与成分の含有量
- 一日当たりの摂取目安量
- 届出番号
- 食品関連事業者の連絡先
- 摂取の方法
- 摂取する上での注意事項
- 保存の方法
(常温で保存すること以外にその保存の方法に関し留意すべき事項がない場合は、その旨を記載します) - 調理又は保存の方法に関し特に注意を必要とするものにあっては当該注意事項
(留意すべき事項がない場合は、その旨を記載します) - その他
参考資料
※1 公益財団法人 日本健康・栄養食品協会(2017),機能性表示食品 届出資料作成の手引書,機能性の科学的根拠,p96-99
※2 消費者庁 【食品関連事業者向け】機能性表示食品の届出について,機能性表示食品の届出等に関するガイドライン(令和5年9月29日一部改正),p7-8
※3 消費者庁,保健機能食品についてのパンフレット,p19-26
※4 消費者庁,保健機能食品についてのパンフレット,p26-27
※5 公益財団法人 日本健康・栄養食品協会(2017),機能性表示食品 届出資料作成の手引書,機能性の科学的根拠,p153
※6 公益財団法人 日本健康・栄養食品協会(2017),機能性表示食品 届出資料作成の手引書,機能性の科学的根拠,p142-145
*いずれも2024年2月19日時点の情報です