制造销售医疗器械
更新日:2024年3月20日
◆もくじ◆
制造销售医疗器械
在日本国内制造医疗器械并销售的话,同时需要制造贩卖业许可和制造业注册。
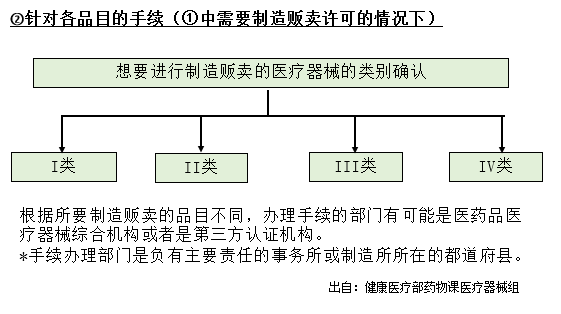
下面的流程图中①为办理制造许可与注册手续时需要进行的业务,②为每个医疗器械对应类别下品目所需的手续。
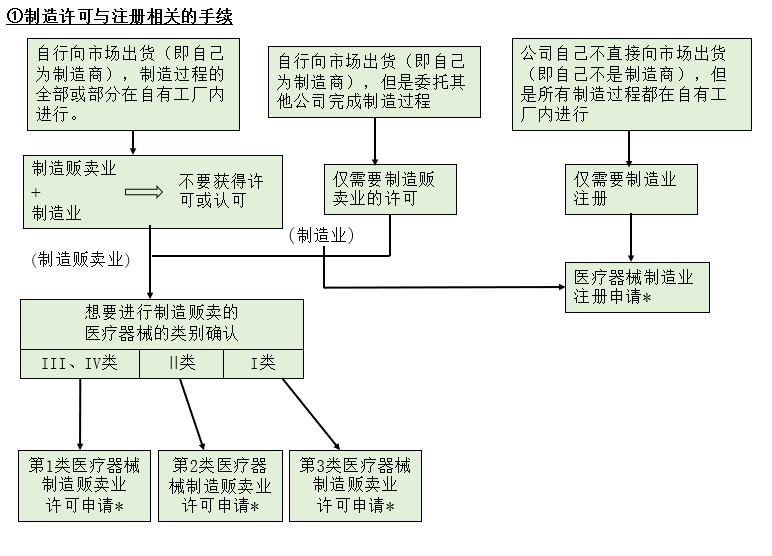
什么是医疗器械制造贩卖业?
是指制造医疗器械(包含委托他人制造的情况),或者在海外制造的医疗器械后进口后,负责通过向贩卖业者销售、出租或者授权等,在市场上分销医疗器械。这也包括通过互联网提供医疗机器程序的情形。
制造或进口医疗器械只能向贩卖业者或出租业者销售、出租或授权,不能向医院或一般消费者进行销售等。
制造贩卖业的许可的种类
| 类别 | 分类 | 許可の種類 | 申请受理部门 |
| Ⅳ | 高度管理医疗器械 | 第一种医疗器械制造贩卖业许可 | 都道府县 |
| Ⅲ | |||
| Ⅱ | 管理医疗器械 | 第二种医疗器械制造贩卖业许可 | |
| Ⅰ | 一般医疗器械 | 第三种医疗器械制造贩卖业许可 |
制造贩卖业的许可要件
请在制造贩卖业的许可要件的页面查看具体内容。
什么是医疗器械制造业?
受医疗器械制造贩卖业者委托生产医疗器械的制造所必须注册为医疗器械制造业。
这种医疗器械制造业的注册必须是以每个制造所单位进行,而非每个企业。
该制造工程是指设计、主要组装、灭菌和成品仓储等各个过程。执行这个制造过程的制造所必须注册为医疗器械制造商。
2014年修法前,设计过程并未包含在其中,但是修法后,新增加了设计过程。另外,修法后,不再包括贴标签等包装及标签工序。
生产非主要组装工艺和部件的制造所不需要注册为医疗器械制造业。
需要注册的制造所的范围
必须进行制造业注册的工程包括设计、主要组装、灭菌、和成品仓储、其定义如下:
| 工程 | 内容 |
| 设计 | 负责需批准或认证的医疗器械的设计开发的设施,管理与该设计开发相关的各项记录的场所 |
| 主要组装 | 在实际制造过程中,对该产品的质量管理监督体系或产品实现负有实质责任的设施 |
| 灭菌 | 对灭菌医疗器械,进行灭菌的设施 |
| 成品仓储 | 在保管成品的设施内,在产品出货之前存储产品的设施 |
是否需要进行制造业的注册见下表。根据医疗器械种类的不同,具体在哪个阶段需要制造业注册也会有所变化。
| 制造工程 | 医疗器械 (不包括右边各项) | Ⅰ类医療器械 | 软件程序 | 软件程序的硬件载体 |
| 设计 | 需要 | 不要 | 需要 | 需要 |
| 主要组装 | 需要 | 需要 | 不要 | 不要 |
| 灭菌 | 需要 | 需要 | 不要 | 不要 |
| 成品仓储 | 需要 | 需要 | 不要 | 需要 |
医疗器械制造业注册的要件
请在医疗器械制造业注册的要件页面查看。
医疗器械各品类的手续
为了在市场上销售各个医疗器械,在获得上述许可或注册后,需要完成每个医疗器械的所需手续。医疗器械必须根据其分类,办理相应的手续。
| 类别 | 申请名 | 申请受理部门 |
| 一般医疗器械 (I类) | 制造贩卖备案 | 医药品医疗器械综合机构(PMDA) |
| 管理医疗器械 (II类) | 制造贩卖认证申请 | 第三方认证机构 or 医药品医疗器械综合机构(PMDA) |
| 高度管理医疗器械(Ⅲ・Ⅳ类) | 制造贩卖批准申请 | 第三方认证机构 or 医药品医疗器械综合机构(PMDA) |
咨询与医疗器械有关的许可、认可及批准等相关事宜,请联系我们。
我们向新进入医疗器械行业的企业以及现有的制造贩制造商、生产商和经销商提供有关药品和医疗器械等法相关申请支持和咨询服务。
医疗器械的申请是高度专业化的,能够完美处理这些业务的行政书士比较少。
而我们提供医疗器械相关的法律服务的基础是我们作为企业代理人向日本行政机关申请与斡旋沟通时所积累的丰富经验和优秀业绩。
我们的团队拥有在日本所有都道府县的申请经验。请务必与我们联系以获取更多信息。


