更新日:2024年3月20日
如果已经完成承认、认证和备案的医疗器械有变更的话,
往往需要快速办理完手续。
在这种情况下,可怕的是在不知不觉中就超过了最后期限,
然后在变更后发现已经不再符合许可或注册的要求了。
这是可能影响公司经营的重大事件。
为了避免这种情况发生,需要准确了解“应进行变更手续的变更”和“不用进行变更手续的变更”,并正确地应对。
我们在医疗设备的制造销售企业以及制造企业的变更手续方面积累了丰富的经验。
如果您考虑进行任何变更,请随时与我们联系。
我们将说明该变更应履行的手续,并且提出适用于您公司的最佳解决方案,从资料收集开始,到进行涵盖与申请机构的谈判在内的实际手续代办,为您提供全方位的支持。
下文是与产品变更相关的手续的一般概述。
医疗器械的变更手续流程和注意要点
※参考:平成26年11月20日 药食机参发1120第1号 “关于作成医疗器械制造贩卖承认申请书时应注意事项”、平成26年11月20 日药食机参发1120第4号 “关于作成医疗器械制造贩卖认证申请书时应注意事项”、平成26年11月21日 药食机参发1121第41号”关于医疗器械制造贩卖备案时应注意事项”、平成20年10月23日 药食机发1023001号 “关于医疗器械部分变更的手续”。
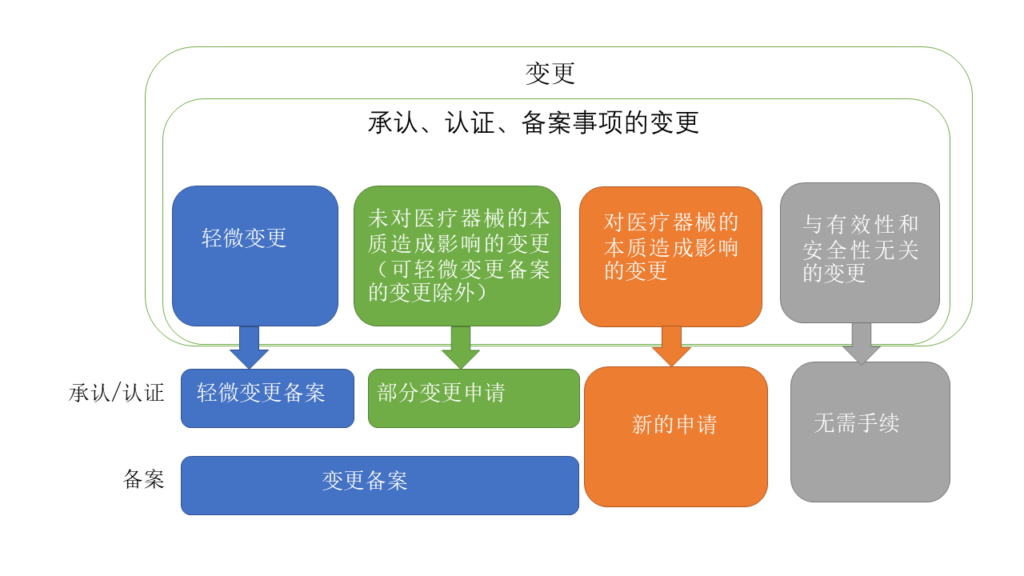
关于变更手续的种类
关于手续,可以大致分为以下几类。
((为避免复杂化,本次不讨论特例处理相关的分类。))
实际上,需要考虑变更所产生的影响来确定手续。
因此,针对实际变更判断需要采取哪种手续的难度变得很高。
手续 | 变更内容 | 根据 |
轻微变更备案 (承认/认证) | 一 使用目的或效果的增加、修改或删除 二 关于病原因子的不活化或去除方法的变更 三 除前两项所列的变更外,影响产品的品质、有效性及安全性,且被厚生劳动大臣认定为必须获得法第二十三条之二之五第十一款规定的承认的变更 | 药品、医疗器械等的质量、有效性和安全性保证等法律实施规则第114条之25(认证适用于上述规定(第118条)) |
部分变更承认申请 ((承认/认证)) | 原则上,以下类型的变更,如果不会对该医疗器械的本质等产生影响,可以通过承认事项的部分变更承认申请进行(可通过轻微变更届进行的变更除外)。 (1)结构、原材料、性能等方面的轻度变更 (2)名称、形状、尺寸、使用目的或效果、性能以及安全性相关的规格等的变更 | 平成26年11月20日、药食机参发1120第1号和平成26年11月20日、药食机参发1120第4号 |
变更备案 (备案) | 根据上述轻微变更备案和部分变更申请的范围进行处理 | 平成26年11月21日 药食机参发1121第41号 |
新的申請 ((承认/认证/备案)) | 原则上,以下类型的变更需要通过新的承认申请进行。 (事例) ① 结构、原材料、性能等方面的变更中除去可通过部分变更承认申请进行的变更之外的变更 ② 贩卖名称的追加 | 平成26年11月20日、药食机参发1120第1号和、平成26年11月20日、药食机参发1120第4号 |
无需手续 (承认/认证/备案) | 变更内容经综合判断后和有效性及安全性不具有直接关联性,从该医疗器械的本质看来不会损害同一性 | 平成20年10月23日药食机发第1023001号 |
变更手续的期限
医疗器械的制造销售商,在变更后的30天内,
必须向PMDA或进行认证申请的注册认证机构提交必要的文件。
然而,在需要进行新的申请手续的情况下,需进行承认或者认证申请。
这是因为不能进行追溯的承认或者认证。
建议从计划阶段就留出几个月时间,以便进行充分考虑。
请联系我们
如前所述,我们在医疗器械制造销售商和制造商的变更手续相关方面拥有丰富的经验,我们的专业人员快速、可靠地为客户代理各种申请。
并且,我们还在日本设有四个办事处,分别位于东京(新宿和秋叶原)、名古屋和大阪,以此为基点,在全日本范围内提供服务。
我们也通过互联网等方式接受来自海外的咨询。
我们有能够用中文、英文和韩文提供支持和服务的工作人员,因此即使是日语沟通存在困难的情况下,我们也能够提供支持和服务。
请将这样专业又复杂的手续交给我们处理。
我们提供委托前的免费咨询服务,无论问题大小,都请随时与我们联系,我们将竭诚为您提供帮助。



