医療機器申請連載2.認証申請書添付資料で示すもの
投稿日:2019年10月24日
こんにちは、サポート行政書士法人の大串です。
前回「医療機器申請連載1.医療機器申請の概要」では、添付資料において「認証基準への適合性に関する資料」と「基本要件基準への適合性に関する資料」を示すとお伝えしました。
今回は上記が一体何を意図するのかについてお伝えします。
はじめに 略称
以下に今回使用する略称を記載します。
法:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律
規則:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則
認証申請添付資料留意事項通知:平成27年1月20日付け薬食機参発0120第1号「医療機器の製造販売認証申請書添付資料の作成に際し留意すべき事項について」
局長通知:平成26年22月30日付け薬食発1120第8号「医療機器の製造販売認証申請について」
認証基準への適合性に関する資料
「認証基準への適合性に関する資料」は、正確には「法第23条の2の23第1項の厚生労働大臣が定める基準への適合性に関する資料」を指します(規則第115条第2項)。
具体的な内容は下記です(認証申請添付資料留意事項通知別表)。
1.申請に係る医療機器が認証基準の定めのある医療機器に該当することを説明する資料
2.当該医療機器の使用目的又は効果について説明する資料
3.認証基準において引用する日本工業規格又は国際電気標準会議が定める規格への適合性を示す資料
4.既存の医療機器と明らかに異なるものではないことを説明する資料
これをSTED形式の添付資料に落とし込んだものを下の図2-1に示します。
基本要件基準への適合性に関する資料
「基本要件基準への適合性に関する資料」は、正確には「法第41条第3項又は法第42条第1項若しくは第2項の規定により基準が設けられている場合にあつては、当該基準への適合性に関する資料」を指します(規則第115条第2項)。
具体的には以下を指します(認証申請添付資料留意事項通知通知の別表)。
1.基本要件基準への適合宣言に関する資料
2.基本要件基準への適合に関する資料
3.基本要件基準への適合性を証明する試験に関する資料
4.法第42条第2項による基準への適合性を説明する資料
これをSTED形式の添付資料に落とし込んだものを下の図2-1に示します。
図2-1.添付資料の内容について、規則と認証申請添付資料留意事項通知通知の別表
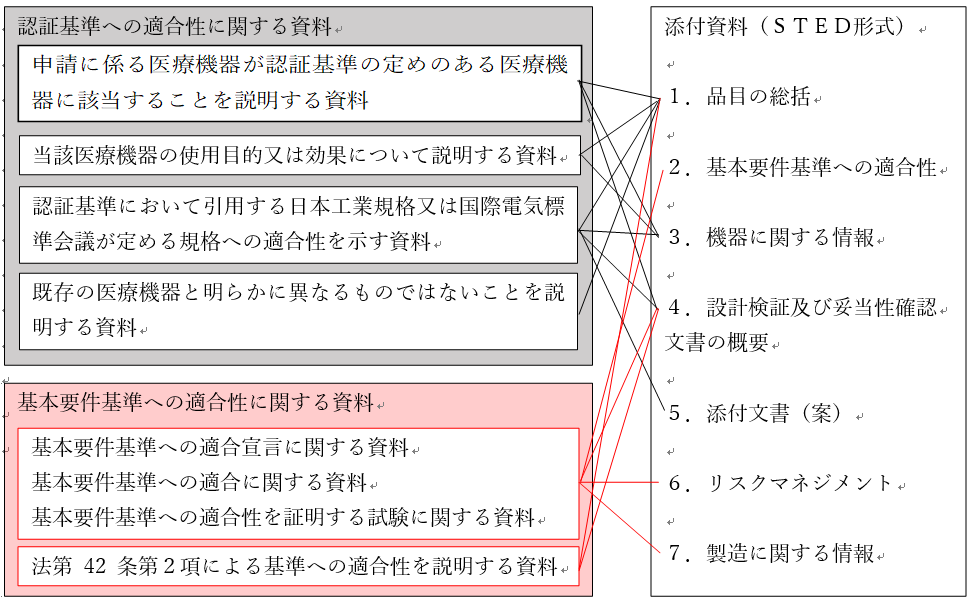
規則が求めるものをSTED形式に落とし込むと、項目数が変わり順番も入れ替わりがあり、とちょっとややこしいので、こういった図示が一番理解しやすいですよね。
さて次回からは、認証申請資料の信頼性についてお伝えしようと思います。
引き続きおつきあいくださいませ。
